Version interactive avec LaTeX compilé
Différentes méthodes de conservation des aliments
Ce sujet se propose d'étudier des moyens de conservation des aliments par des méthodes physiques (réfrigération) et chimiques (utilisation d'antioxydants et de conservateurs).
Certaines données numériques sont regroupées en fin d'énoncé.
Certaines données numériques sont regroupées en fin d'énoncé.
I Machine frigorifique à absorption
De l'avis de l'historien Hugo Obermaier (1877-1946), dès le paléolithique inférieur (100 000 ans avant JésusChrist), les hommes ont commencé à utiliser le froid existant dans les grottes pour conserver le gibier. Sans comprendre ces phénomènes, ces hommes utilisaient sans doute l'abaissement de température produit en partie par l'évaporation de l'eau, en partie par la détente de l'air dans les crevasses communiquant avec l'extérieur.
Q 1. À partir de considérations simples, expliquer ces deux hypothèses. On pourra raisonner sur l'humidité de l'air et préciser le modèle de détente.
Au début du xix
Q 1. À partir de considérations simples, expliquer ces deux hypothèses. On pourra raisonner sur l'humidité de l'air et préciser le modèle de détente.
Au début du xix

Figure 1
Une réfrigérateur à absorption est un récepteur thermique fonctionnant par contact avec trois «thermostats», sans recevoir de travail mécanique. La source chaude à la température
On désigne par
Q 2. Déterminer les signes des transferts thermiques
Q 3. Comparer les valeurs absolues
Q 4. Définir le coefficient de performance (noté COP ) de cette machine et donner son expression littérale.
Q 5. En utilisant les deux principes de la thermodynamique sur un cycle, montrer que
Q 6. Étudier la limite de
Q 7. Quel avantage de ce type de machine peut-on prévoir par rapport à une machine à compression de fluide?
À partir de 1885, le système à compression de vapeurs liquéfiables commença à prendre le net avantage qui est devenu éclatant au cours du xx
On désigne par
Q 2. Déterminer les signes des transferts thermiques
Q 3. Comparer les valeurs absolues
Q 4. Définir le coefficient de performance (noté COP ) de cette machine et donner son expression littérale.
Q 5. En utilisant les deux principes de la thermodynamique sur un cycle, montrer que
Q 6. Étudier la limite de
Q 7. Quel avantage de ce type de machine peut-on prévoir par rapport à une machine à compression de fluide?
À partir de 1885, le système à compression de vapeurs liquéfiables commença à prendre le net avantage qui est devenu éclatant au cours du xx
II Machine frigorifique à compression de vapeur
On considère une machine frigorifique constituée d'un compresseur, d'un condenseur, d'un détendeur et d'un évaporateur, dans lesquels circule un fluide frigorigène R134a.
Q 8. Sur un schéma de principe, identifier les différents transferts énergétiques qui interviennent au sein de la machine entre les différents éléments schématisés figure 2 et donner leur signe.
Q 8. Sur un schéma de principe, identifier les différents transferts énergétiques qui interviennent au sein de la machine entre les différents éléments schématisés figure 2 et donner leur signe.
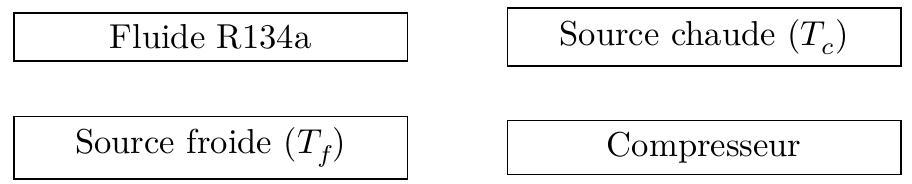
Figure 2
Q 9. Quel est le rôle du condenseur et au contact de quel élément de la figure 2 doit-il être mis ?
Q 10. Quel est le rôle de l'évaporateur et au contact de quel élément doit-il être mis ?
Q 11. Définir le coefficient de performance (COP) de cette machine puis exprimer le coefficient de performance de la machine de Carnot correspondante.
Q 10. Quel est le rôle de l'évaporateur et au contact de quel élément doit-il être mis ?
Q 11. Définir le coefficient de performance (COP) de cette machine puis exprimer le coefficient de performance de la machine de Carnot correspondante.
Pour toute la suite, on néglige toute variation d'énergie cinétique massique et d'énergie potentielle massique. De plus, on suppose un régime d'écoulement permanent au débit massique
Pour simplifier, on considère la compression adiabatique et réversible. Le détendeur D , calorifugé et sans parties mobiles, permet une chute de pression. L'évaporateur EV et le condenseur CD sont des échangeurs thermiques isobares. Les notations des états du fluide sont précisées sur la figure 3.
Pour simplifier, on considère la compression adiabatique et réversible. Le détendeur D , calorifugé et sans parties mobiles, permet une chute de pression. L'évaporateur EV et le condenseur CD sont des échangeurs thermiques isobares. Les notations des états du fluide sont précisées sur la figure 3.
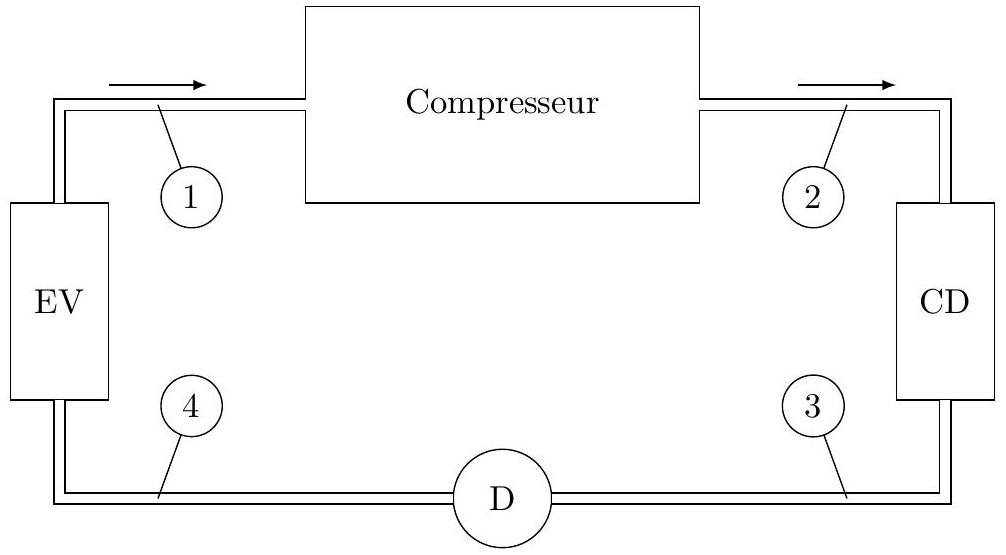
Figure 3
Q 12. Établir le premier principe pour un kilogramme de fluide frigorifique en écoulement stationnaire unidimensionnel dans un système à une entrée et une sortie. On notera
Q 13. Montrer que le fluide subit une détente isenthalpique dans D.
La figure A du document réponse (à rendre avec la copie) représente l'allure du cycle décrit par le fluide dans le diagramme dit «des frigoristes » enthalpie massique
Seul le point 1, à l'entrée du compresseur, est mentionné sur ce diagramme.
Q 14. En repérant la courbe de saturation et les abaques de température, noter sur le diagramme les domaines où le fluide est à l'état liquide, vapeur sèche et vapeur-humide (ou mélange liquide-vapeur)
Q 15. Dans quel sens est parcouru le cycle ? Lorsqu'un cycle est parcouru dans le sens trigonométrique sur un diagramme de Clapeyron, la quantité de chaleur reçue par cycle est négative et donc fournie à l'extérieur. En est-il de même sur ce cycle dans le diagramme des frigoristes ? sur tout cycle ?
Q 16. Quelle est la forme des isothermes à l'intérieur de la courbe de saturation ? Justifier.
Q 17. Quelle est la forme des isothermes dans le domaine de la vapeur sèche ? Justifier lorsque l'on peut assimiler la vapeur sèche à un gaz parfait.
Q 18. Porter le numéro de chaque état du fluide ( 2,3 et 4 ) dans chaque case prévue.
Q 19. Noter sur le diagramme, pour chacune des quatre transformations, la nature de la transformation et l'organe (compresseur, condenseur, détendeur, évaporateur) traversé par le fluide.
Q 20. Compléter le tableau du document réponse en s'aidant du diagramme.
Q 21. Exprimer, puis calculer, le travail massique indiqué
Q 13. Montrer que le fluide subit une détente isenthalpique dans D.
La figure A du document réponse (à rendre avec la copie) représente l'allure du cycle décrit par le fluide dans le diagramme dit «des frigoristes » enthalpie massique
Seul le point 1, à l'entrée du compresseur, est mentionné sur ce diagramme.
Q 14. En repérant la courbe de saturation et les abaques de température, noter sur le diagramme les domaines où le fluide est à l'état liquide, vapeur sèche et vapeur-humide (ou mélange liquide-vapeur)
Q 15. Dans quel sens est parcouru le cycle ? Lorsqu'un cycle est parcouru dans le sens trigonométrique sur un diagramme de Clapeyron, la quantité de chaleur reçue par cycle est négative et donc fournie à l'extérieur. En est-il de même sur ce cycle dans le diagramme des frigoristes ? sur tout cycle ?
Q 16. Quelle est la forme des isothermes à l'intérieur de la courbe de saturation ? Justifier.
Q 17. Quelle est la forme des isothermes dans le domaine de la vapeur sèche ? Justifier lorsque l'on peut assimiler la vapeur sèche à un gaz parfait.
Q 18. Porter le numéro de chaque état du fluide ( 2,3 et 4 ) dans chaque case prévue.
Q 19. Noter sur le diagramme, pour chacune des quatre transformations, la nature de la transformation et l'organe (compresseur, condenseur, détendeur, évaporateur) traversé par le fluide.
Q 20. Compléter le tableau du document réponse en s'aidant du diagramme.
Q 21. Exprimer, puis calculer, le travail massique indiqué
Q 22. Exprimer, puis calculer, le transfert thermique massique
Q 23. En utilisant le débit massique, exprimer puis calculer la puissance frigorifique
Q 24. Exprimer, puis calculer, le coefficient de performance de cette installation frigorifique. Le comparer au coefficient de performance de la machine de Carnot correspondante et interpréter la différence observée.
Q 25. On souhaite améliorer la puissance frigorifique de
Les fluides utilisés dans les systèmes précédents sont malheureusement des gaz à effet de serre, qui contribuent au réchauffement climatique. Des recherches sont menées pour tenter de trouver de nouveaux gaz frigorifiques moins polluants. Parallèlement, de nouvelles technologies sont à l'étude, pour réaliser des systèmes à haute efficacité énergétique, tout en ayant un impact environnemental faible.
Q 23. En utilisant le débit massique, exprimer puis calculer la puissance frigorifique
Q 24. Exprimer, puis calculer, le coefficient de performance de cette installation frigorifique. Le comparer au coefficient de performance de la machine de Carnot correspondante et interpréter la différence observée.
Q 25. On souhaite améliorer la puissance frigorifique de
Les fluides utilisés dans les systèmes précédents sont malheureusement des gaz à effet de serre, qui contribuent au réchauffement climatique. Des recherches sont menées pour tenter de trouver de nouveaux gaz frigorifiques moins polluants. Parallèlement, de nouvelles technologies sont à l'étude, pour réaliser des systèmes à haute efficacité énergétique, tout en ayant un impact environnemental faible.
III Réfrigération magnétique
Technologie émergente, la réfrigération magnétique exploite une propriété de certains matériaux : l'effet magnétocalorique. Celui-ci se traduit par un échauffement ou refroidissement du matériau lorsqu'il est aimanté ou désaimanté de manière adiabatique. En 1996, l'Américain Zimm et son groupe de recherche ont développé un réfrigérateur produisant entre 500 et 600 W de puissance frigorifique sous un champ magnétique de 5 T . Le matériau utilisé était du gadolinium (Gd). La figure 4 présente le principe de l'effet magnétocalorique.
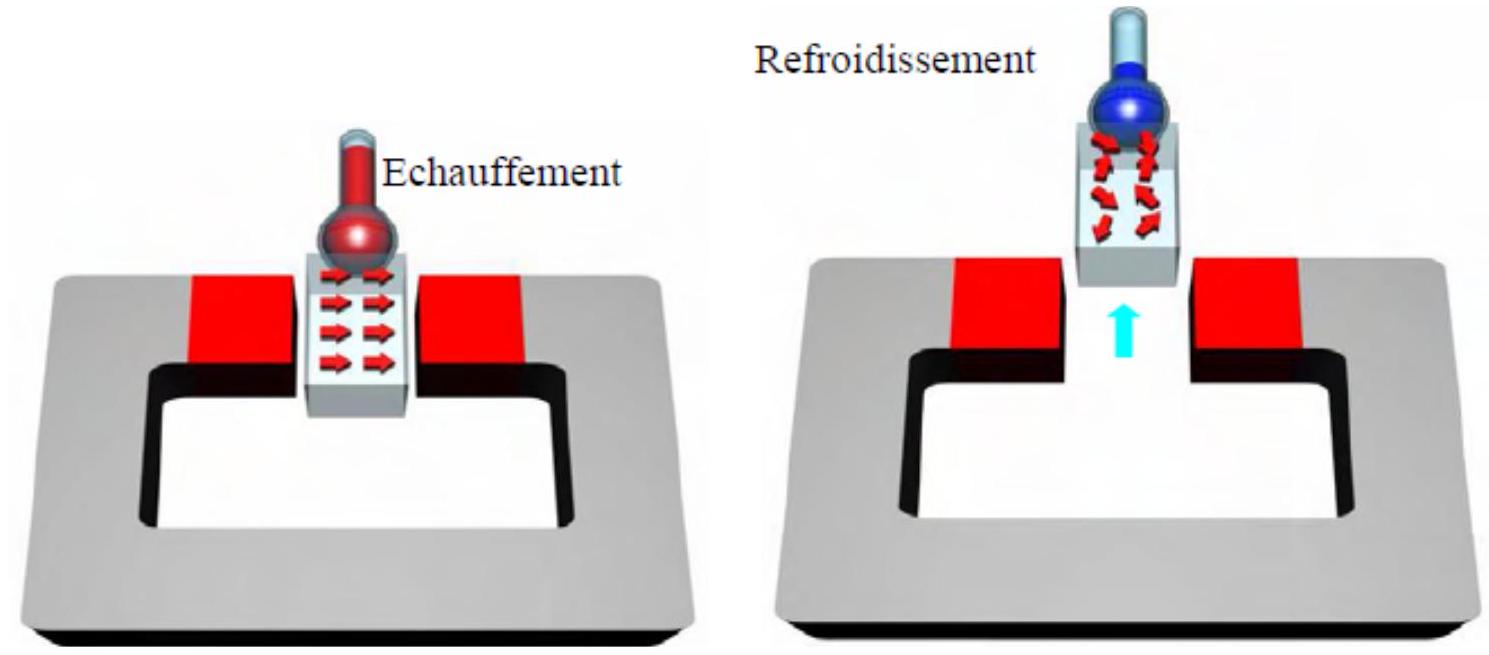
Figure 4 Principe de l'effet magnétocalorique - Aimantation à gauche, désaimantation à droite
L'entropie totale
Q 26. Sous l'action d'un champ magnétique (phase d'aimantation), les moments magnétiques du matériau s'alignent. En déduire le sens de variation de l'entropie magnétique
Q 27. Si l'on suppose le processus adiabatique et réversible, exprimer la variation
Q 28. Expliquer comment la désaimantation du matériau peut permettre un refroidissement de celui-ci.
On peut montrer que la variation de température
Q 26. Sous l'action d'un champ magnétique (phase d'aimantation), les moments magnétiques du matériau s'alignent. En déduire le sens de variation de l'entropie magnétique
Q 27. Si l'on suppose le processus adiabatique et réversible, exprimer la variation
Q 28. Expliquer comment la désaimantation du matériau peut permettre un refroidissement de celui-ci.
On peut montrer que la variation de température
où
Q 29. Montrer que cette relation est en accord avec la conclusion obtenue à la question précédente.
Q 30. La figure 5 représente la variation d'entropie magnétique
Pour le gadolinium,
Q 31. Calculer le refroidissement magnétocalorique du gadolinium autour de
Q 29. Montrer que cette relation est en accord avec la conclusion obtenue à la question précédente.
Q 30. La figure 5 représente la variation d'entropie magnétique
Pour le gadolinium,
Q 31. Calculer le refroidissement magnétocalorique du gadolinium autour de
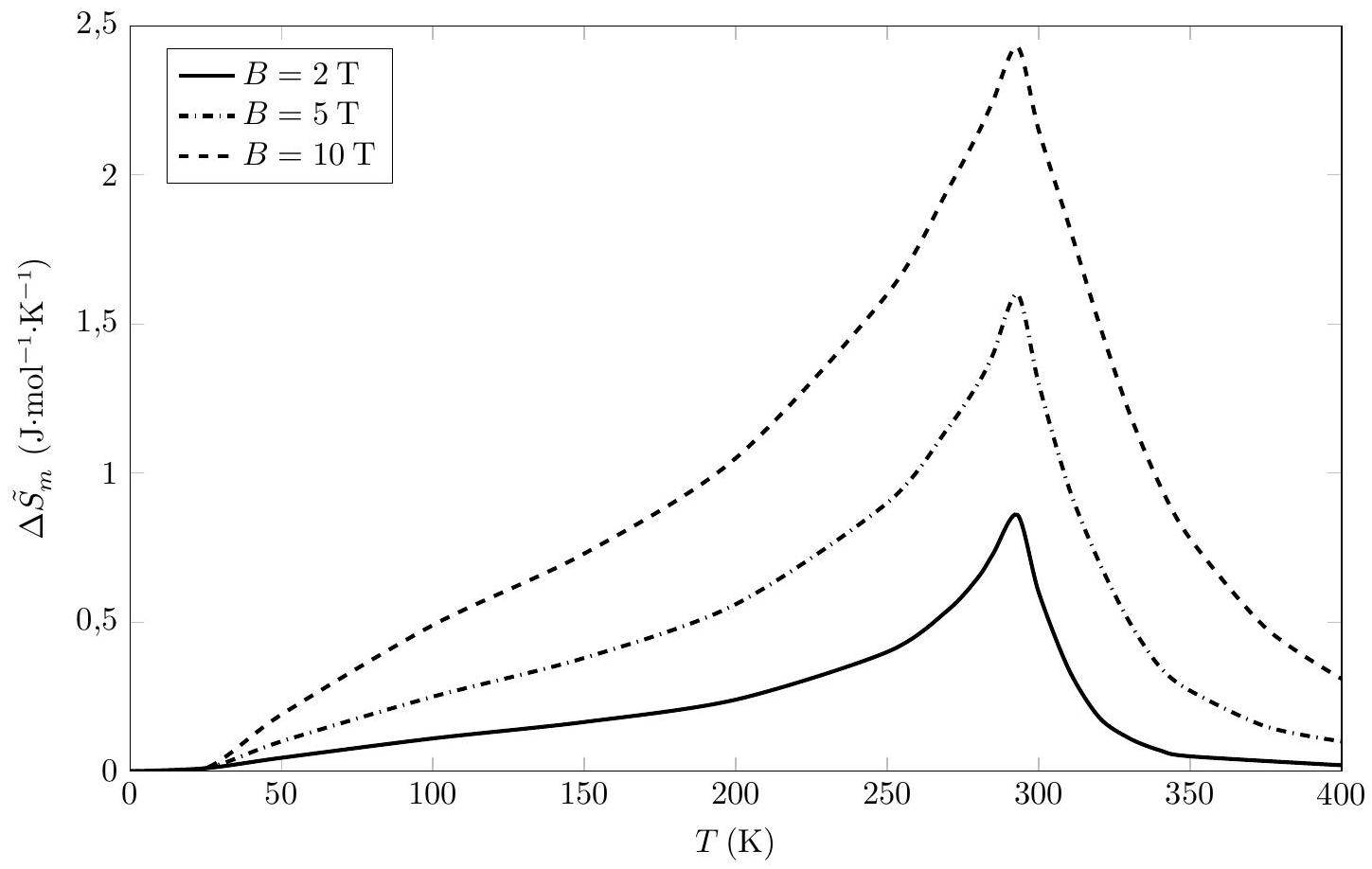
Figure 5
Sachant que le gadolinium est l'un des meilleurs matériaux magnétocalorique disponible actuellement, cet EMC correspond à la valeur absolue maximale entre le réservoir chaud et le réservoir froid.
Q 32. Est-il possible d'imaginer l'exploitation de cet EMC dans la plupart des applications de réfrigération ?
Q 32. Est-il possible d'imaginer l'exploitation de cet EMC dans la plupart des applications de réfrigération ?
IV Utilisation d'un anti-oxydant
Pour protéger les aliments d'une attaque bactérienne (lutte contre le pourrissement), l'industrie agroalimentaire utilise un conservateur. Pour éviter l'oxydation (changement de couleur des aliments, altération, rancissement), elle emploie un anti-oxydant.
Les antioxydants sont des espèces chimiques qui évitent l'oxydation des aliments. Dans la classification agroalimentaire, les antioxydants sont numérotés de E300 à E337.
Q 33. Lorsqu'on laisse une tranche de pomme à l'air libre, au bout de quelques minutes elle brunit. Si préalablement, cette tranche a été arrosée de jus de citron ou d'orange, le brunissement n'a plus lieu. En outre, une tranche d'orange garde sa couleur. Conclure sur la composition des agrumes.
La vitamine C (ou acide ascorbique), qui a pour code E300, est utilisée comme agent antioxydant pour la conservation de certains aliments. Elle est présente dans le jus d'orange. On se propose de titrer la vitamine C de formule brute
Les antioxydants sont des espèces chimiques qui évitent l'oxydation des aliments. Dans la classification agroalimentaire, les antioxydants sont numérotés de E300 à E337.
Q 33. Lorsqu'on laisse une tranche de pomme à l'air libre, au bout de quelques minutes elle brunit. Si préalablement, cette tranche a été arrosée de jus de citron ou d'orange, le brunissement n'a plus lieu. En outre, une tranche d'orange garde sa couleur. Conclure sur la composition des agrumes.
La vitamine C (ou acide ascorbique), qui a pour code E300, est utilisée comme agent antioxydant pour la conservation de certains aliments. Elle est présente dans le jus d'orange. On se propose de titrer la vitamine C de formule brute
- Étape 1 - Presser une orange et filtrer le jus. Prélever
de ce jus et les introduire dans un erlenmeyer de 100 mL . - Étape 2 - Verser environ
d'acide phosphorique à dans l'erlenmeyer. - Étape 3 - Introduire dans l'erlenmeyer
de solution de diiode à . Le diiode est placé en large en excès. Agiter. Attendre environ 20 minutes. - Étape 4 - Titrer la solution avec une solution de thiosulfate de sodium à
. Lors de la décoloration de la solution, le volume versé de solution titrante est .
IV.A - Diagramme
Le diagramme E-pH simplifié de l'élément iode I (trait continu) est donné figure 6. Il est tracé pour une concentration atomique en élément iode de
Sur la frontière entre deux espèces solubles, on admettra l'égalité des concentrations atomiques de l'élément considéré.
Le diagramme de la vitamine C (trait discontinu) est superposé à celui de l'iode. La vitamine C est un diacide. Les espèces considérées pour ce diagramme sont
La frontière entre le couple
Sur la frontière entre deux espèces solubles, on admettra l'égalité des concentrations atomiques de l'élément considéré.
Le diagramme de la vitamine C (trait discontinu) est superposé à celui de l'iode. La vitamine C est un diacide. Les espèces considérées pour ce diagramme sont
La frontière entre le couple
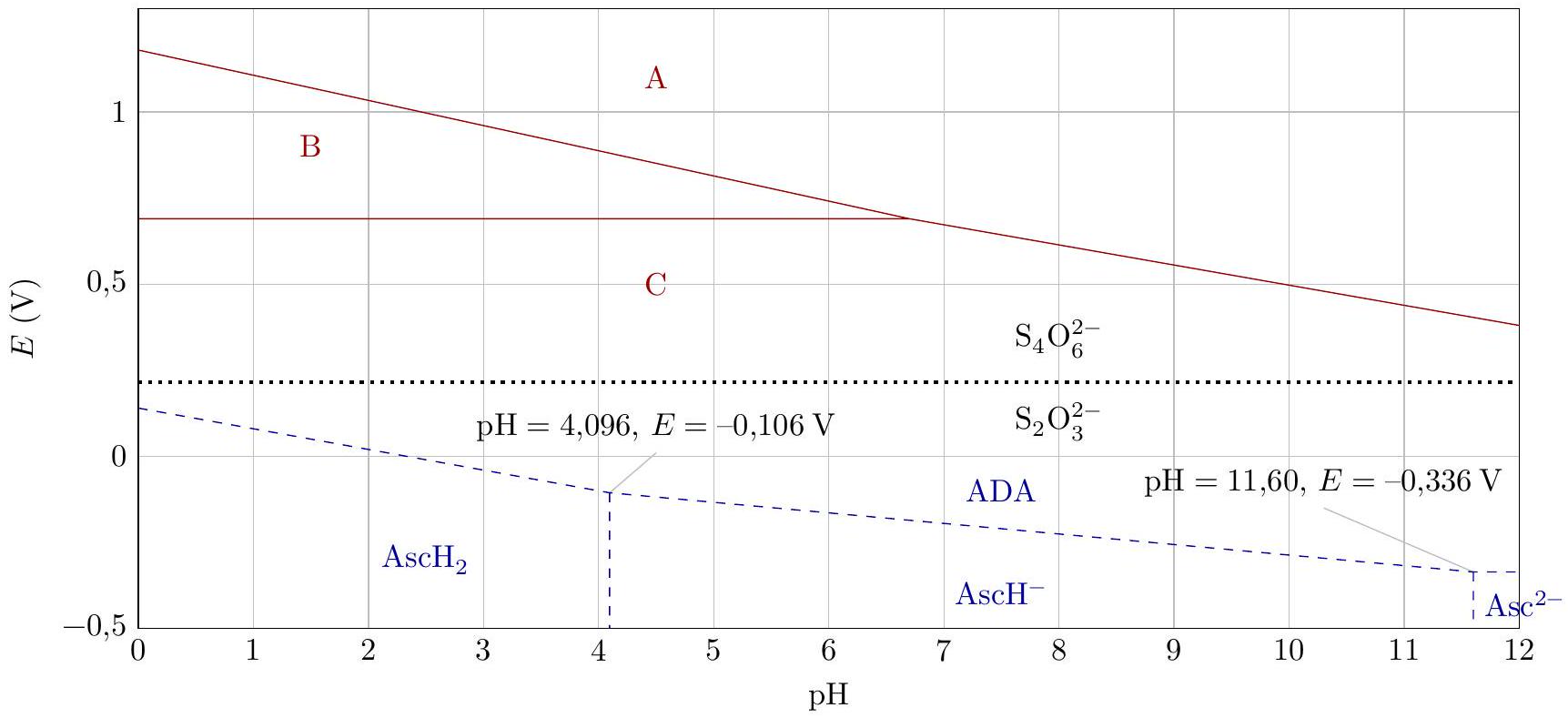
Figure 6 Diagrammes E-pH simplifiés de l'iode (
Q 34. Justifier que le domaine B correspond au diiode
Q 35. Déterminer, par le calcul, la pente de la frontière entre les domaines
Q 36. À l'aide du diagramme E-pH, déterminer la valeur du
Q 35. Déterminer, par le calcul, la pente de la frontière entre les domaines
Q 36. À l'aide du diagramme E-pH, déterminer la valeur du
IV.B - Analyse des différentes étapes
Q 37. À l'aide du digramme E-pH de l'iode, expliquer pourquoi dans l'étape 2, on ajoute de l'acide phosphorique avant d'ajouter le diiode. Donner le type de réaction faisant intervenir le diiode
Q 38. Nommer les instruments de verrerie nécessaires pour prélever
Au cours de l'étape 3, l'équation qui modélise la transformation chimique s'écrit :
Q 38. Nommer les instruments de verrerie nécessaires pour prélever
Au cours de l'étape 3, l'équation qui modélise la transformation chimique s'écrit :
Q 39. À l'aide des diagrammes E-pH, justifier que l'acide ascorbique
Q 40. Justifier que, dans l'étape 3, on demande dans le protocole: « Attendre environ 20 minutes ».
L'équation de la réaction support du titrage se produisant au cours de l'étape 4 est
Q 40. Justifier que, dans l'étape 3, on demande dans le protocole: « Attendre environ 20 minutes ».
L'équation de la réaction support du titrage se produisant au cours de l'étape 4 est
On supposera que cette réaction est rapide.
Q 41. Calculer la constante d'équilibre de la réaction de titrage (IV.2). Conclure.
Q 41. Calculer la constante d'équilibre de la réaction de titrage (IV.2). Conclure.
IV.C - Détermination du titre massique d'acide ascorbique dans un jus d'orange
Q 42. Exprimer la quantité de matière
Q 43. Exprimer la quantité de matière
Q 44. En déduire la quantité de matière d'acide ascorbique
Q 45. En déduire la concentration massique
Q 43. Exprimer la quantité de matière
Q 44. En déduire la quantité de matière d'acide ascorbique
Q 45. En déduire la concentration massique
V Étude d'un conservateur agroalimentaire, l'acide benzoïque
L'acide benzoïque est un conservateur alimentaire ayant pour code E210. Un conservateur empêche la multiplication et le développement de certaines bactéries. Grâce aux additifs de conservation, les aliments ont des dates de péremption plus longues. L'acide benzoïque est notamment utilisé dans les jus de fruit pour lesquels les industriels préconisent une concentration d'acide benzoïque d'environ
On s'intéresse dans cette partie à la réaction de dissolution de l'acide benzoïque dans l'eau:
Q 46. Exprimer la constante d'équilibre en fonction des activités des différentes espèces. Que valent ces activités?
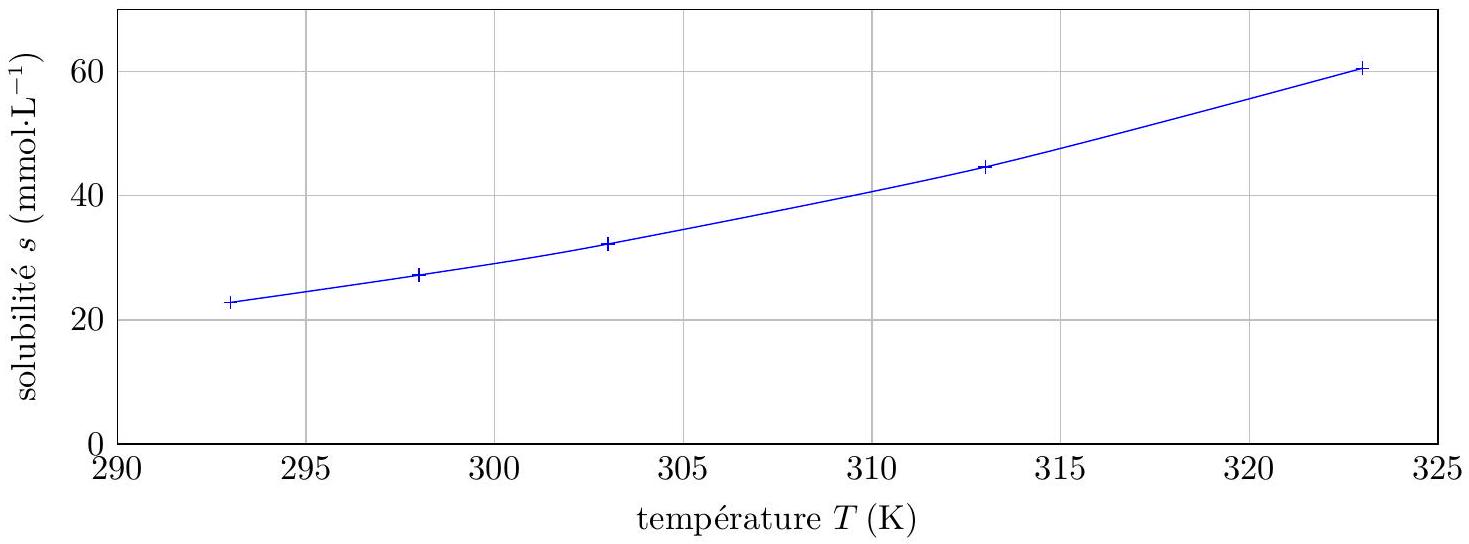
Figure 7 Influence de la température sur la solubilité de l'acide benzoïque
Q 47. À
Q 48. Déterminer en justifiant le signe de l'enthalpie standard de réaction
Q 49. À l'aide des différentes courbes de la figure
À
Q 48. Déterminer en justifiant le signe de l'enthalpie standard de réaction
Q 49. À l'aide des différentes courbes de la figure
À
Q 50. Comment varie la concentration de l'acide benzoïque en phase aqueuse lors de l'ajout de la solution d'hydroxyde de sodium ? En déduire le sens de déplacement de l'équilibre (V.1).
Données
Les valeurs dépendantes de la température sont fournies à 298 K .
- Formules brutes. Vitamine
. Radical phényl ( ) : . - Potentiels standard
| Couple |
|
|
|
||
|
|
0,62 | 0,08 | 0,13 |
- Masses molaires
| Acide ascorbique | Acide benzoïque |
|
|
|
- Constantes d'acidité
| Couple |
|
|
|
|
|
4,2 | 14,0 | 0 |
- Constante des gaz parfaits :
. - Relation de Van't Hoff :
.
Questions 14, 18 et 19
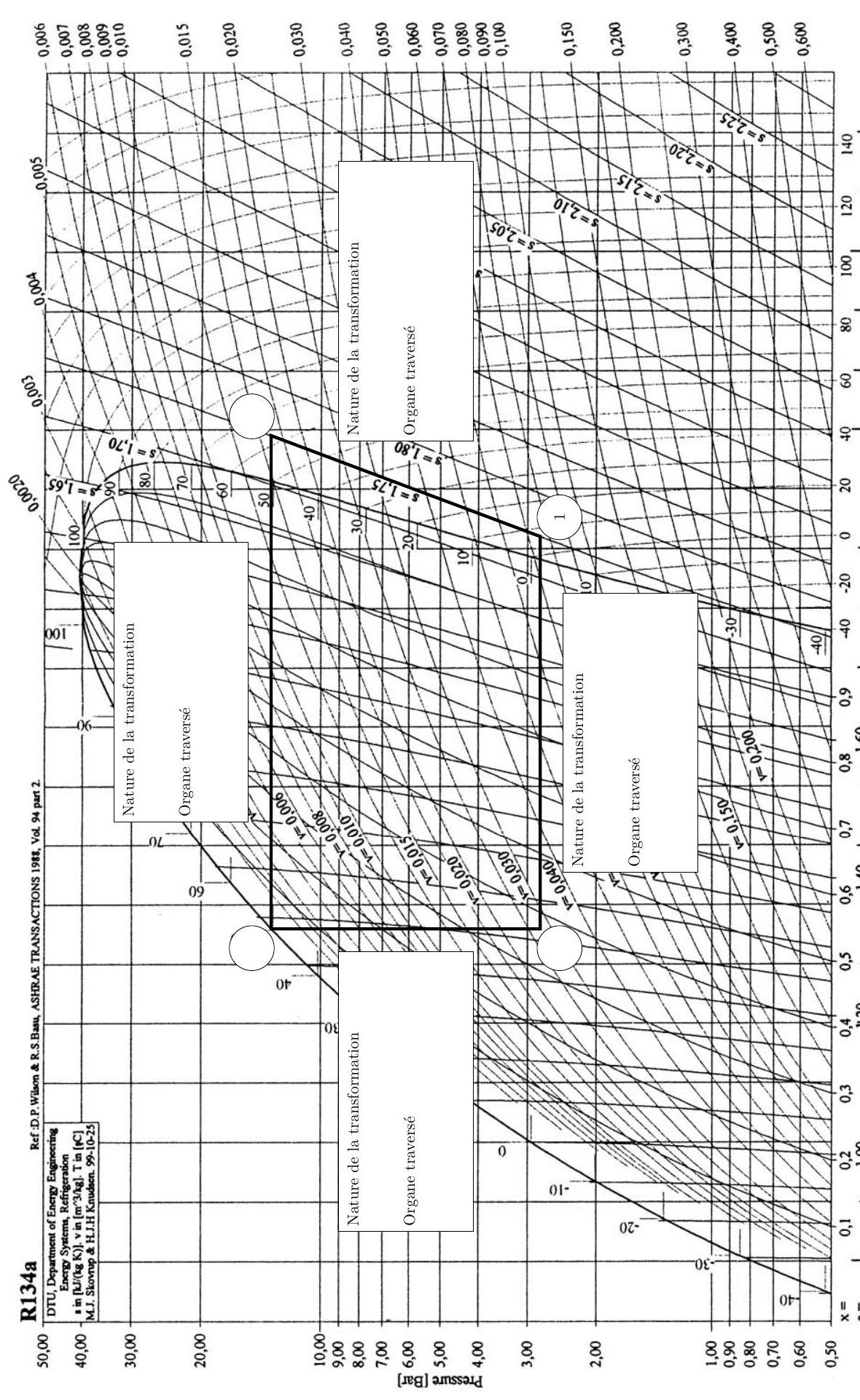
Figure A
Question 20
Question 20
| État du fluide | 1 | 2 | 3 | 4 |
| Pression (bar) | ||||
| Température (
|
||||
| Enthalpie massique (
|
||||
| Titre en vapeur |
Question 49
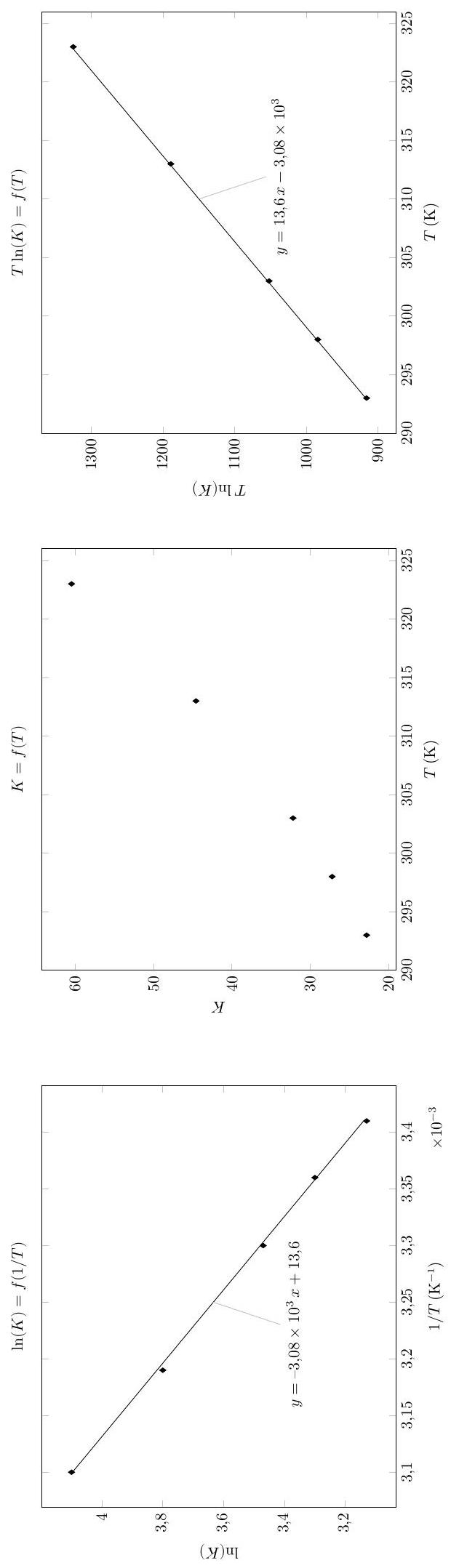
Figure B
