Version interactive avec LaTeX compilé
ÉCOLE NORMALE SUPÉRIEURE DE LYON
CONCOURS D'ADMISSION 2023
VENDREDI 21 AVRIL 2023
08h00-13h00
FILIÈRE PC - Épreuve
PHYSIQUE-CHIMIE (L)
08h00-13h00
FILIÈRE PC - Épreuve
PHYSIQUE-CHIMIE (L)
Durée : 5 heures
- L'utilisation de calculatrices n'est pas autorisée pour cette épreuve.
- Les parties relatives à la chimie et à la physique doivent être rédigées sur des copies distinctes, et en tête desquelles doit être mentionné "Chimie" ou "Physique".
- Les copies doivent être numérotées continûment, sur l'ensemble des deux parties.
Cette épreuve comprend deux parties indépendantes. La première concerne la physique et propose une étude du phénomène d'effusion gazeuse. La seconde est dédiée à la chimie et s'intéresse à quelques aspects de la chimie du bore.
Partie Physique : Effusion gazeuse
Nous notons
Ses quatre premières valeurs sont les suivantes :
- La pesanteur n'est pas prise en compte.
- Le gaz est monoatomique et parfait.
- Sa température reste fixée par un thermostat.
Nous nous proposons d'étudier le phénomène d'effusion gazeuse. Ce phénomène se rapporte à l'échappement d'un gaz à travers un orifice percé dans la paroi de l'enceinte contenant ce gaz. Le régime d'échappement est effusif lorsque le trou est tel que les atomes (ou molécules) le franchissent sans subir de collision entre eux (elles) (hypothèse notée
Cette étude comprend quatre parties. La première porte sur des considérations générales. La seconde est consacrée à l'étude de la distribution des vitesses des atomes d'un gaz à l'équilibre thermodynamique. La troisième s'intéresse à l'expression du flux effusif. Enfin, la quatrième propose quelques applications. Les deux premières parties sont indépendantes. La troisième est liée à la deuxième et la quatrième à la troisième.
Notations, données et formulaire - Hypothèses générales.
- Constante de Boltzmann :
- Température de thermalisation :
- Masse d'un atome (hélium) du gaz :
- Volume d'une enceinte (supposée cubique) :
- Aire de la section de l'orifice d'effusion (trou circulaire)
Nous notons
Ses quatre premières valeurs sont les suivantes :
- Ses évolutions sont considérées comme étant quasi-statiques. Cela signifie, en particulier, que les gran- deurs thermodynamiques intensives se rapportant au gaz seront considérées, à tout instant, comme uniformes dans chacune des enceintes.
1 Considérations préliminaires.
Nous considérons deux enceintes cubiques identiques, de volume
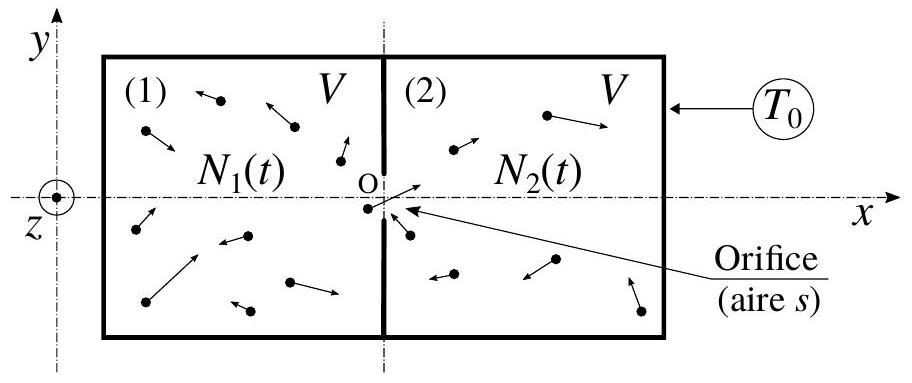
Figure 1 - Deux enceintes cubiques identiques (1) et (2), de volume
Nous notons
- Rappeler la définition du "libre parcours moyen", que nous noterons
, d'un atome (ou d'une molécule) dans un gaz. - L'échappement du gaz par un trou s'effectue en régime effusif à condition que l'hypothèse, notée
dans la présentation de l'étude, soit vérifiée. Indiquer quelle condition l'aire de la section du trou doit alors satisfaire. - Représenter, qualitativement, l'allure de l'évolution temporelle de chacun des nombres d'atomes
et . - Préciser de quelles grandeurs le temps caractéristique
de ces évolutions dépend, a priori.
Indiquer s'il apparaît alors possible d'accéder à la forme de la dépendance de
5. Analyser le caractère réversible ou irréversible de ces évolutions.
5. Analyser le caractère réversible ou irréversible de ces évolutions.
2 Distribution des vitesses des atomes du gaz.
Dans cette partie, nous nous plaçons dans le cas général d'un gaz (monoatomique) contenu dans une enceinte thermalisée à la température
La probabilité élémentaire
La probabilité élémentaire
Nous notons, parallèlement :
Par ailleurs, la moyenne d'une grandeur
- Indiquer la condition que la constante
doit satisfaire. En déduire l'expression de cette constante en fonction de et du produit . - Représenter l'allure graphique de la fonction
pour deux températures et (en correspondance, sur le même repère). Commenter ces tracés. - La valeur moyenne
s'exprime par une relation qui prend la forme suivante :
Exprimer la fonction
9. Exprimer les moyennes
9. Exprimer les moyennes
Commenter chacun de ces résultats.
Calculer l'ordre de grandeur de
Calculer l'ordre de grandeur de
3 Expression du flux effusif.
Il s'agit d'exprimer le nombre d'atomes sortant de l'enceinte (1) au profit de l'enceinte (2), par unité de temps (nous ne nous préoccupons pas, dans cette section (3), des atomes qui franchissent le trou dans l'autre sens). Choisissons, arbitrairement, un domaine élémentaire de vitesse
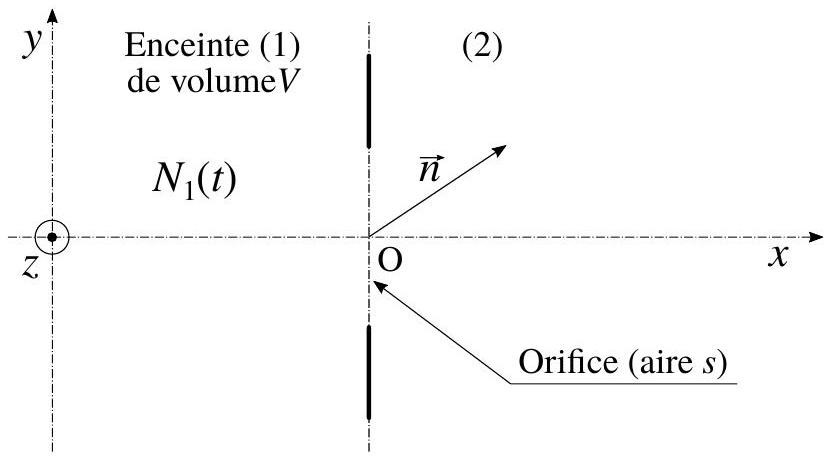
Figure 2 - Vecteur unitaire
- Reproduire le schéma de la figure (2). Y représenter le volume élémentaire dD contenant l'ensemble des atomes qui s'échapperont de l'enceinte (1), par le trou, entre les instants
et , et dont la vitesse est égale à (à près). Exprimer puis le nombre élémentaire d'atomes qu'il contient. On exprimera la grandeur en fonction de et . - En prenant en compte la distribution des vitesses définie par l'équation (3), exprimer le nombre moyen d'atomes sortant de l'enceinte (1), par unité de temps. Nous notons
cette grandeur et l'écrivons sous la forme suivante :
Exprimer la constante positive
N.B. : Dans la suite, on utilisera directement la relation (7), en conservant le paramètre
12. Calculer l'ordre de grandeur de
13. Commenter ce résultat, notamment au regard des hypothèses adoptées.
14. Nous souhaitons que le libre parcours moyen
N.B. : Dans la suite, on utilisera directement la relation (7), en conservant le paramètre
12. Calculer l'ordre de grandeur de
13. Commenter ce résultat, notamment au regard des hypothèses adoptées.
14. Nous souhaitons que le libre parcours moyen
En déduire l'expression de la pression
Donnée : Le libre parcours moyen d'une particule, en mouvement au sein de ses semblables, est lié à la section
4 Dynamique d'échange d'atomes.
Cette partie met en œuvre l'équation (7), dans quelques situations particulières.
4.1 Système fermé formé de deux enceintes.
Nous nous plaçons ici dans la situation décrite dans la partie (1) où deux enceintes identiques, thermalisées à la température
15. Établir le système d'équations différentielles vérifié par les nombres d'atomes
16. Exprimer la solution
17. Il est possible de tirer parti du phénomène d'effusion gazeuse pour isoler, au moins partiellement, un composant particulier d'un gaz. Pour illustrer cette application, nous supposons que le gaz est formé de deux types d'atomes (a) et (b) et qu'il est initialement entièrement contenu dans l'enceinte (1). Il s'agit de recueillir, dans les meilleures conditions, un gaz enrichi (ou appauvri) de l'un de ses composants.
15. Établir le système d'équations différentielles vérifié par les nombres d'atomes
16. Exprimer la solution
17. Il est possible de tirer parti du phénomène d'effusion gazeuse pour isoler, au moins partiellement, un composant particulier d'un gaz. Pour illustrer cette application, nous supposons que le gaz est formé de deux types d'atomes (a) et (b) et qu'il est initialement entièrement contenu dans l'enceinte (1). Il s'agit de recueillir, dans les meilleures conditions, un gaz enrichi (ou appauvri) de l'un de ses composants.
Expliquer sur quelle propriété du phénomène d'effusion cette application repose.
Justifier qu'il existe un instant optimal pour arrêter l'effusion. Exprimer le temps
Indiquer dans quelle situation concrète cette technique de séparation a été, ou peut être, utilisée.
N.B. : Il s'agit, dans cette question (17), de mettre en place quelques étapes qu'il conviendra de présenter clairement, avec les éventuelles notations introduites.
Justifier qu'il existe un instant optimal pour arrêter l'effusion. Exprimer le temps
Indiquer dans quelle situation concrète cette technique de séparation a été, ou peut être, utilisée.
N.B. : Il s'agit, dans cette question (17), de mettre en place quelques étapes qu'il conviendra de présenter clairement, avec les éventuelles notations introduites.
4.2 Système ouvert formé de deux enceintes.
La situation est la même que celle décrite dans l'étude précédente à la différence près que l'enceinte (2) est ici percée d'un second trou (se reporter à la figure (3)). Ce trou, d'aire
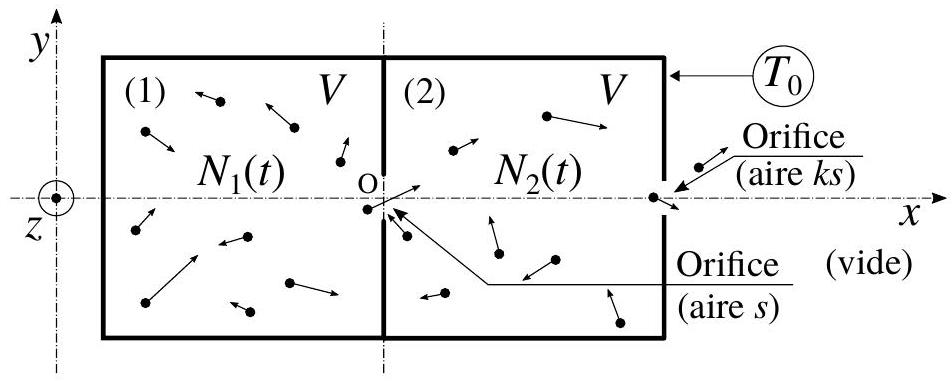
Figure 3 - Deux enceintes cubiques identiques (1) et (2), de volume
- Établir le système d'équations différentielles, paramétré par les seules constantes
et , vérifié par les nombres d'atomes et contenus dans chacune des enceintes. - Former l'équation différentielle vérifiée par la fonction
(paramétrée par les seules constantes et . - Exprimer le facteur de qualité
associé à cette équation différentielle. Analyser ce résultat. - Nous notons
et les racines (qu'il est inutile de calculer) du polynôme caractéristique associé à l'équation différentielle vérifiée par la fonction (se reporter à la question (19)). Sur la base d'arguments physiques (c'est-à-dire non issus de calculs), indiquer pourquoi ces racines sont nécessairement, d'une part réelles, d'autre part négatives. - Exprimer la solution
correspondant aux conditions initiales et 0 , paramétrée par les constantes et . On ne cherchera pas à établir l'expression des racines et . - La figure (4) représente l'évolution du rapport
vis-à-vis de la variable , pour trois valeurs et , du paramètre .
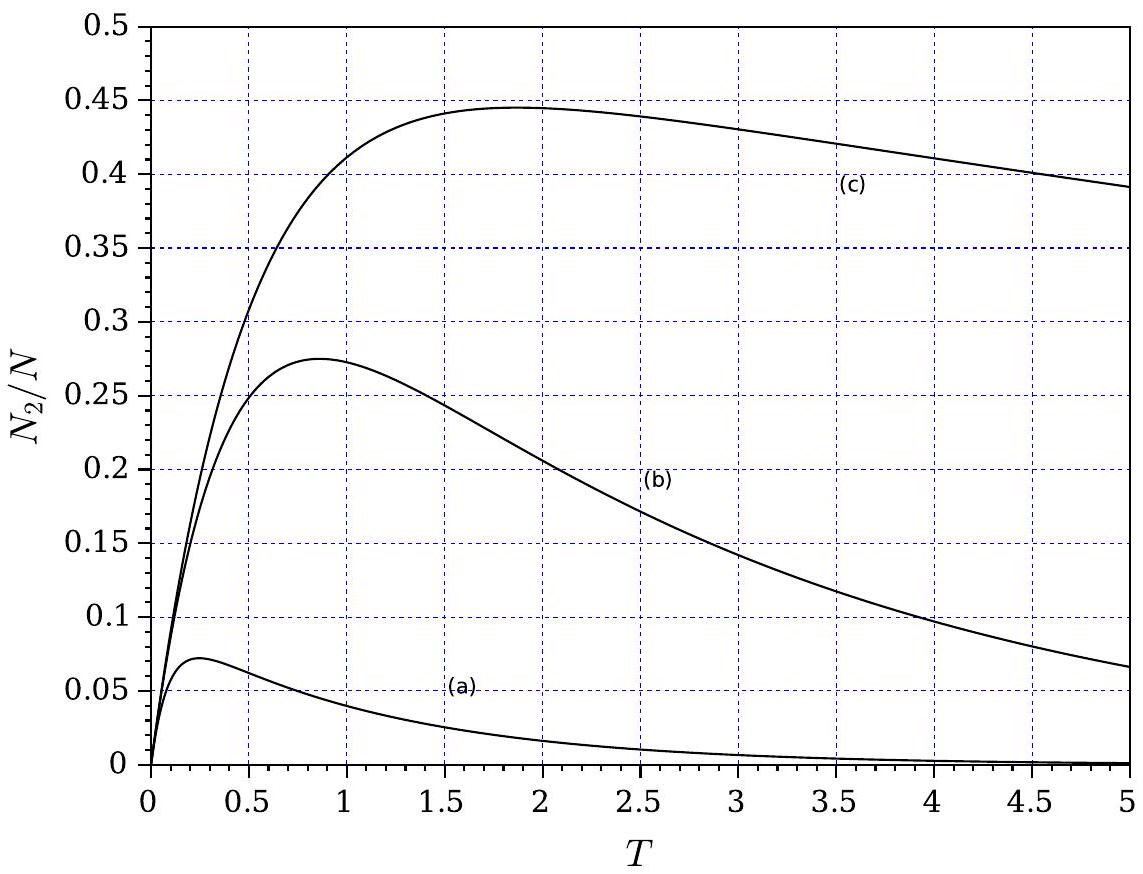
Figure 4 - Évolution du rapport
Indiquer la correspondance, en la justifiant, entre les références (a), (b) et (c) des tracés et les trois valeurs de
Analyser le comportement de ces évolutions aux temps courts (
24. Nous considérons la situation pour laquelle
25. Indiquer comment, expérimentalement (c'est-à-dire en pratique), l'évolution temporelle du nombre
24. Nous considérons la situation pour laquelle
25. Indiquer comment, expérimentalement (c'est-à-dire en pratique), l'évolution temporelle du nombre
4.3 Système formé d'une série d'enceintes.
Le système étudié est maintenant constitué d'une suite de
26. Établir l'équation différentielle reliant
26. Établir l'équation différentielle reliant
- Nous supposons dès lors que
. En vue d'un passage à la limite continue, nous écrivons la variable discrète de la façon suivante :
Nous supposons que la fonction
27. Établir l'équation aux dérivées partielles vérifiée par la fonction
28. Indiquer à quelle condition, portant sur la suite (
29. Nous supposons que le système formé de l'ensemble des enceintes est fermé (c'est-à-dire qu'il n'y a aucune fuite vers l'extérieur). À l'instant intial, la première enceinte contient
27. Établir l'équation aux dérivées partielles vérifiée par la fonction
28. Indiquer à quelle condition, portant sur la suite (
29. Nous supposons que le système formé de l'ensemble des enceintes est fermé (c'est-à-dire qu'il n'y a aucune fuite vers l'extérieur). À l'instant intial, la première enceinte contient
Représenter qualitativement l'allure graphique de l'évolution temporelle de la fonction
4.4 Analogie électrocinétique.
Il s'agit d'établir une analogie, dans le domaine de l'électrocinétique, d'un système
N.B. : Toutes les réponses données devront être clairement argumentées.
- Indiquer, sur la base d'une construction rigoureuse, quels sont les équivalents, pour le système
, d'une charge électrique , d'un courant , d'un potentiel électrique , d'une résistance et d'une capacité . On donnera l'expression de chacun de ces équivalents. En particulier, on exprimera la "résistance effusive" en fonction de et (aire de la section d'un trou). - Représenter, par un schéma, l'analogue électrique du système fermé formé de deux enceintes en communication par l'intermédiaire d'un trou (se reporter à la figure (1)).
- Représenter, par un schéma, l'analogue électrique du système formé de deux enceintes en communication par l'intermédiaire d'un trou (aire
), l'une étant en communication avec l'extérieur (le vide) par l'intermédiaire d'un second trou (aire ) (se reporter à la figure (3)). - Indiquer quelle différence fondamentale il existe toutefois entre le système
et son analogue électrocinétique.
L'élément bore est omniprésent dans toutes les branches de la chimie. Utilisés en chimie organique comme agents réducteurs, pour des couplages carbone-carbone catalysés par du palladium, les composés du bore sont également importants, entre autres, dans l'industrie du verre (verres borosilicatés), en électronique comme agents dopants, ou encore dans des alliages pour aimants permanents. Nous allons étudier ici quelques bique simple, avec occupation des sommets par des atomes d'aluminium et occupation du milieu de chaque donnés en annexe.
1 Les acides de Lewis dérivés du bore.
Les acides et bases de Lewis sont deux immenses familles de composés, particulièrement utilisés en synthèse organique, en tant qu'activateurs de fonctions ou catalyseurs.
De façon classique, un acide de Lewis est une espèce chimique possédant une lacune électronique, et une base de Lewis est une espèce chimique possédant un doublet non liant. Les acides de Lewis vont facilement réagir avec les bases de Lewis, en s'appropriant leurs électrons.
Un adduit de Lewis est une espèce composée d'un acide et d'une base de Lewis liés entre eux par un doublet liant fourni complètement par la base. Ce type de liaison est appelé liaison covalente de coordination.
1.1 Comparaison de
1.1.1 Considérations générales.
- Donner le degré d'oxydation du bore et de l'aluminium dans les structures
et . - Justifier que
et sont bien des acides de Lewis. - Comparer, qualitativement, la force des acides de Lewis
et
1.1.2 Pourquoi
La maille élémentaire de la forme
arête du cube par un atome de fluor (figure (1)). Les rayons ioniques et atomiques de ces éléments sont donnés en annexe.
arête du cube par un atome de fluor (figure (1)). Les rayons ioniques et atomiques de ces éléments sont donnés en annexe.
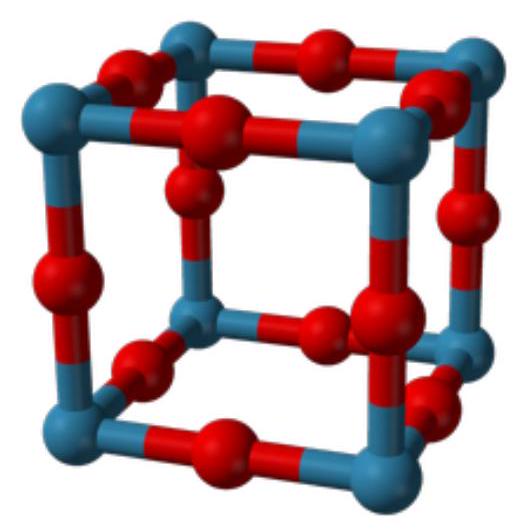
Figure 1 - Structure d'une maille de
- Déterminer les coordinences des atomes d'aluminium et de fluor. Préciser la nature des sites occupés.
- La masse volumique expérimentale du trifluorure d'aluminium est
. En justifiant chaque hypothèse de calcul, et à l'aide des données tabulées, justifier la nature ionique des liaisons fluor-aluminium dans . Commenter. (Une marge d'erreur de sera tolérée dans les résultats numériques.)
Contrairement au trifluorure d'aluminium, dont le point de fusion est d'environ
6. À l'aide de la charge partielle du bore dans
7. Déterminer si les données expérimentales sur
8. Justifier l'appellation de «gaz ionique» pour
6. À l'aide de la charge partielle du bore dans
7. Déterminer si les données expérimentales sur
8. Justifier l'appellation de «gaz ionique» pour
1.2 Étude d'adduits de Lewis.
1.2.1 Approche orbitalaire de la formation d'adduits de Lewis.
- Donner la géométrie de la molécule
.
Pour déterminer les orbitales moléculaires de
10. En considérant les 2 sous-fragments «
11. Déterminer les orbitales du bore susceptibles d'interagir avec les orbitales du fragment «
12. En déduire les représentations des orbitales moléculaires ( OM )
13. Identifier l'orbitale la plus haute occupée (HO) et la plus basse vacante (BV) de l'édifice, et préciser le caractère liant, non liant ou antiliant de chacune de ces deux OM.
10. En considérant les 2 sous-fragments «
11. Déterminer les orbitales du bore susceptibles d'interagir avec les orbitales du fragment «
12. En déduire les représentations des orbitales moléculaires ( OM )
13. Identifier l'orbitale la plus haute occupée (HO) et la plus basse vacante (BV) de l'édifice, et préciser le caractère liant, non liant ou antiliant de chacune de ces deux OM.
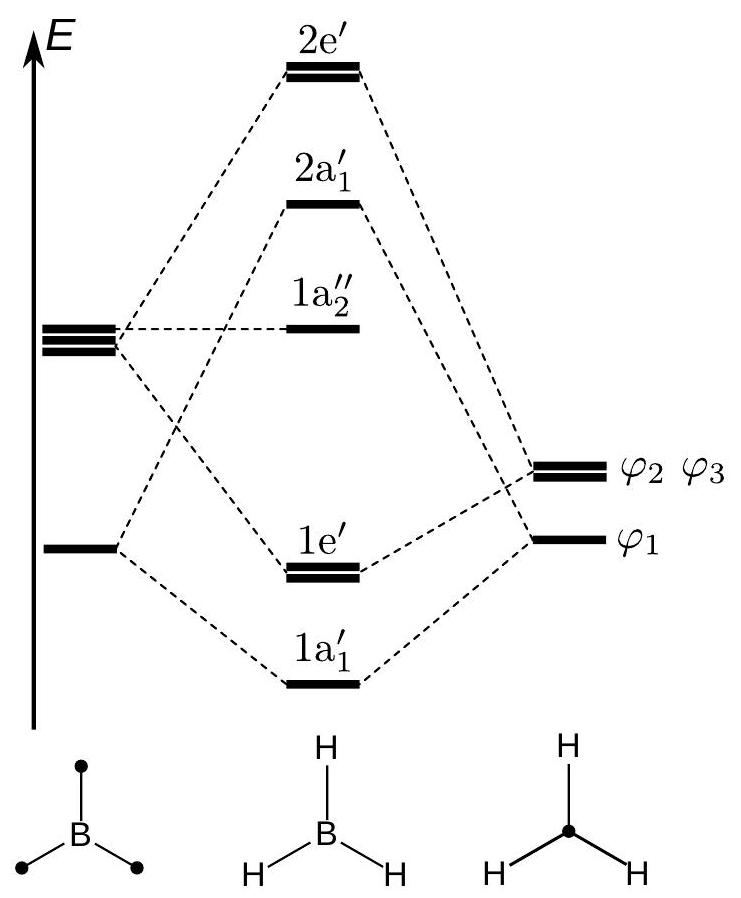
Figure 2 - Diagramme orbitalaire de
La formation de l'adduit de Lewis
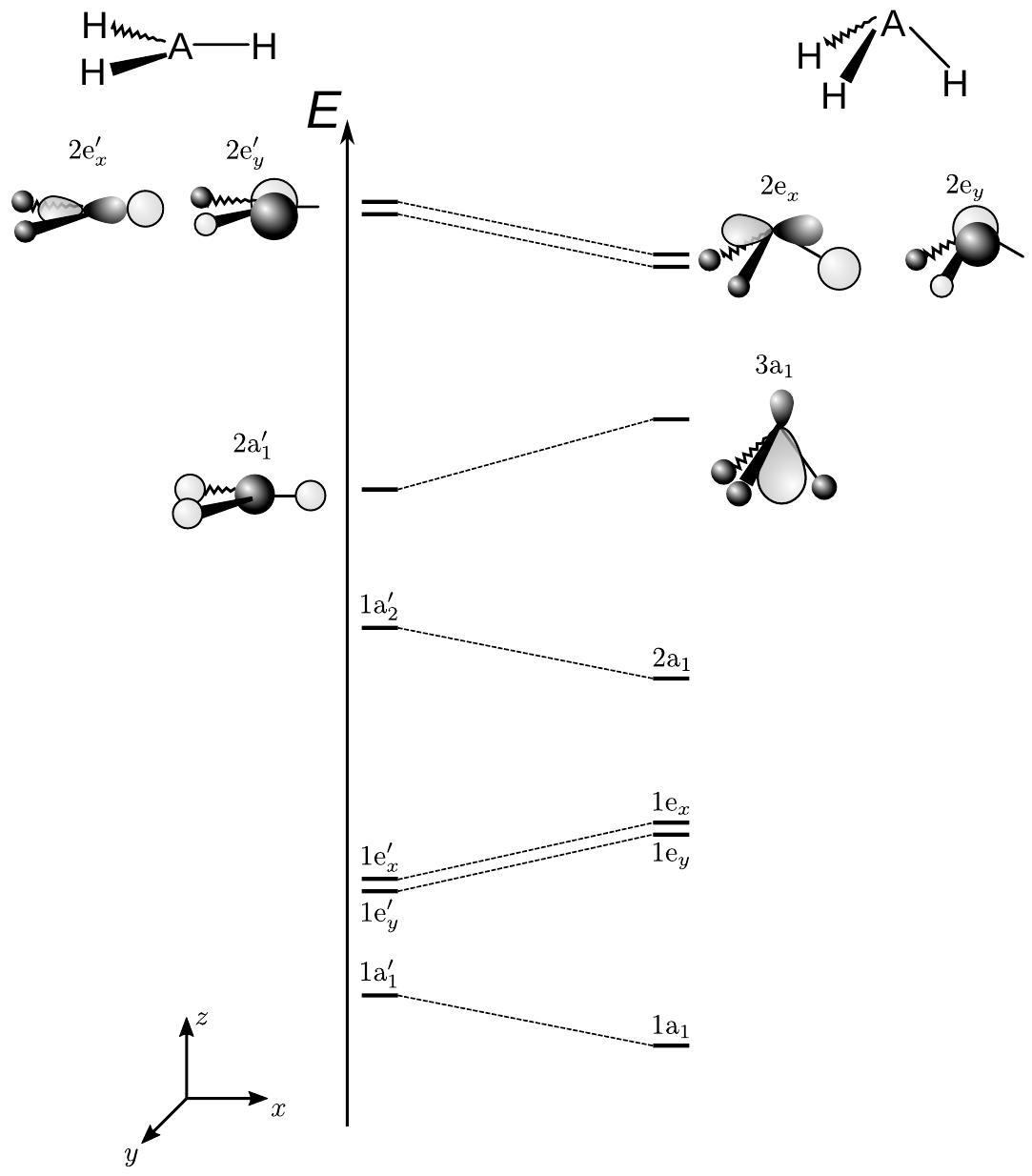
Figure 3 - Diagramme de corrélation de Walsch d'une molécule
- Proposer l'allure des orbitales
et , en s'inspirant des OM représentées sur la figure (3). - Justifier la stabilisation de l'OM
lors du changement de géométrie de . - Préciser en justifiant la(les) différence(s) attendue(s) entre les diagrammes de
et de . - Déterminer les orbitales de
et de qui interagissent pour former la nouvelle liaison. Justifier. - Justifier l'utilisation du terme «liaison covalente de coordination » pour décrire l'interaction bore-azote dans cet adduit.
1.2.2 Paire de Lewis frustrée.
Dans le cas où l'acide de Lewis et la base de Lewis sont très encombrés, aucune liaison ne peut se former. On appelle alors le mélange stœchiométrique d'un tel acide et d'une telle base une « paire de Lewis frustrée ». Un exemple classique est constitué de trimésitylphosphine 1, noté
19. Représenter le produit 1 et justifier qu'il s'agit bien d'une base de Lewis.
20. Représenter le produit 2. Expliquer l'intérêt d'utiliser des substituants fluorés ici.
21. Comparer les niveaux énergétiques de la HO et de la BV d'une paire de Lewis dans le cas où elle formerait une paire frustrée avec le cas où elle forme un adduit de Lewis, et justifier la réactivité de la paire frustrée.
19. Représenter le produit 1 et justifier qu'il s'agit bien d'une base de Lewis.
20. Représenter le produit 2. Expliquer l'intérêt d'utiliser des substituants fluorés ici.
21. Comparer les niveaux énergétiques de la HO et de la BV d'une paire de Lewis dans le cas où elle formerait une paire frustrée avec le cas où elle forme un adduit de Lewis, et justifier la réactivité de la paire frustrée.
Sous atmosphère inerte, on fait buller du dihydrogène pendant 30 minutes dans un mélange équimolaire de 1 et
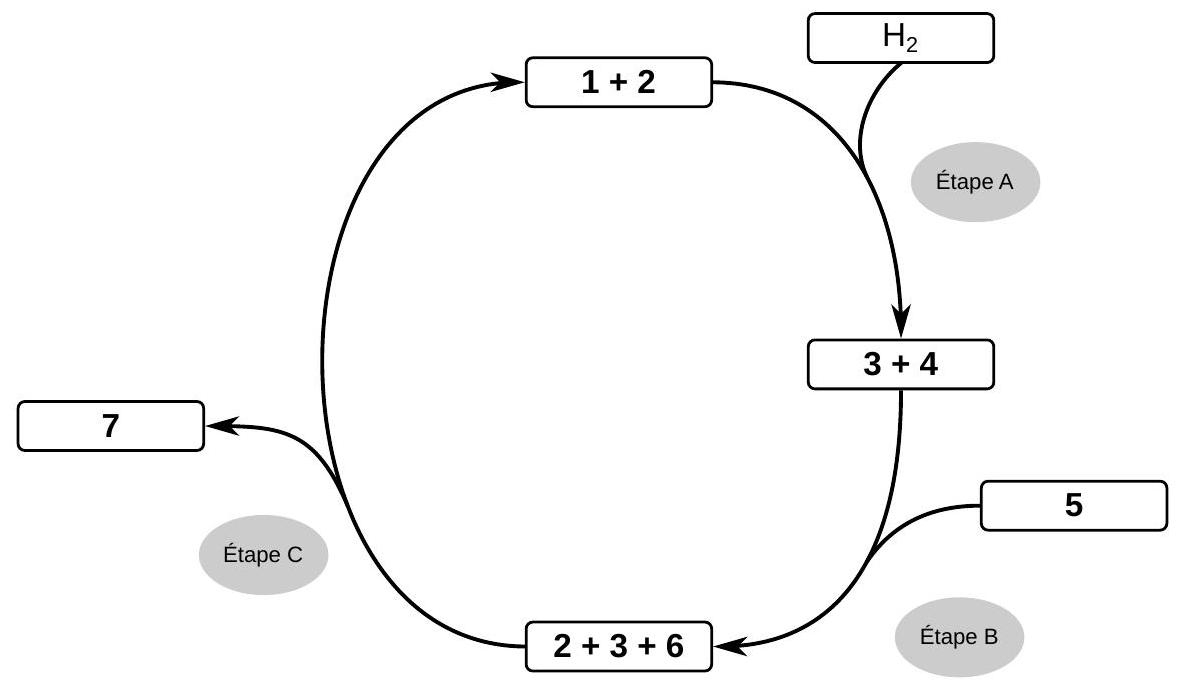
Figure 4 - Cycle catalytique de la réaction.
Le spectre RMN du proton de ce solide ionique est donné tableau (1). Le spectre RMN du bore
| Déplacement chimique (ppm) | Multiplicité | Intégration |
| 7,91 | doublet (
|
1 H |
| 6,58 | doublet (
|
6 H |
| 4,10 | quadruplet (
|
1 H |
| 1,95 | singulet | 9 H |
| 1,87 | singulet | 9 H |
| 1,62 | singulet | 9 H |
Tableau 1 - Tableau des déplacements chimiques du spectre
22. Expliquer l'intérêt d'utiliser un solvant deutéré en RMN du proton, et donner la raison de l'ajout de
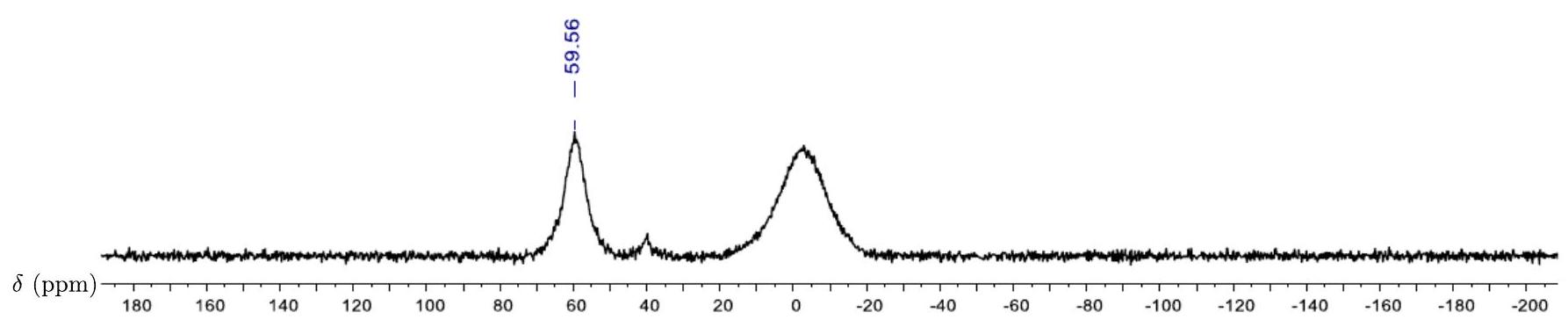
23. Vérifier en justifiant si le spectre RMN
24. À l'aide des spectres obtenus après réaction et de la table de déplacement chimique en annexe (figure (8)), déterminer les structures des composés
25. Attribuer les différents signaux en
Le mélange équimolaire
26. Donner la structure du composé 5. Il est synthétisé à partir de diphénylméthanone
27. Donner la structure de l'intermédiaire 6 et du produit final 7 du cycle catalytique de la figure (4). Attribuer le nom des étapes A, B et C parmi « Transfert de proton», «Coupure hétérolytique» et « Transfert d'hydrure ».
28. Donner deux avantages de ce procédé par rapport à d'autres permettant les mêmes types de réaction.
22. Expliquer l'intérêt d'utiliser un solvant deutéré en RMN du proton, et donner la raison de l'ajout de
23. Vérifier en justifiant si le spectre RMN
24. À l'aide des spectres obtenus après réaction et de la table de déplacement chimique en annexe (figure (8)), déterminer les structures des composés
25. Attribuer les différents signaux en
Le mélange équimolaire
26. Donner la structure du composé 5. Il est synthétisé à partir de diphénylméthanone
27. Donner la structure de l'intermédiaire 6 et du produit final 7 du cycle catalytique de la figure (4). Attribuer le nom des étapes A, B et C parmi « Transfert de proton», «Coupure hétérolytique» et « Transfert d'hydrure ».
28. Donner deux avantages de ce procédé par rapport à d'autres permettant les mêmes types de réaction.
1.3 Un catalyseur au bore particulier : l'oxazaborrolidine CBS.
Dans les années 1980, l'essor de la synthèse asymétrique a donné lieu à d'intenses recherches de cata- lyseurs chiraux permettant de rendre stéréosélective un grand nombre de réactions. Les chimistes Corey, Bakshi et Shibata ont ainsi développé un composé du bore particulier, appelé désormais selon leurs initiales, l'oxazaborrolidine CBS 8. L'oxazaborrolidine CBS est synthétisée à partir de l'ester méthylique de la proline protégée
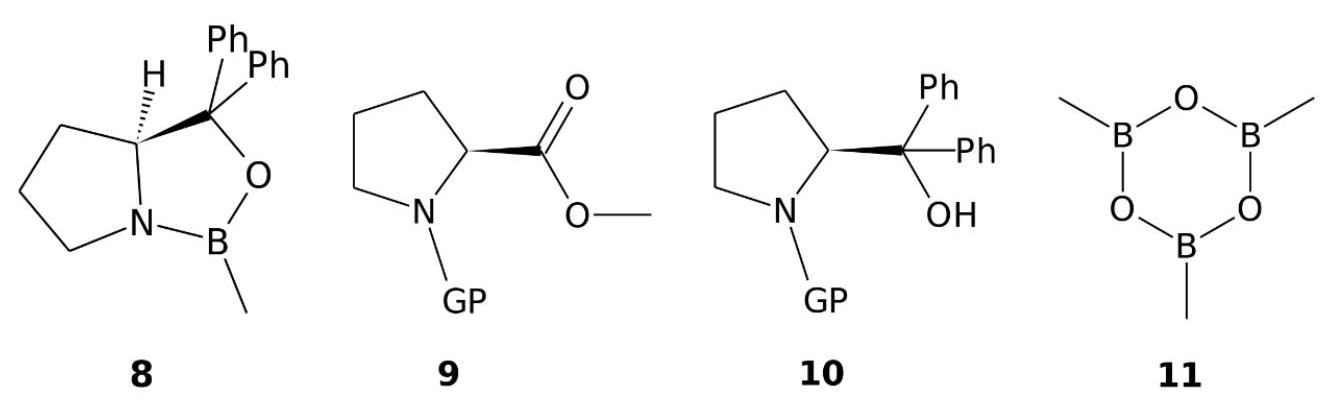
Figure 5 - Structure des produits 8, 9, 10 et 11.
- Rappeler la classe de molécules naturelles dont fait partie la proline.
- Proposer une courte voie de synthèse de l'alcool
groupement phényle à partir de . On supposera que le groupe protecteur «GP» résiste aux conditions expérimentales de cette synthèse.
Le dérivé 10 est déprotégé, puis est mis à réagir avec du tri-méthyl boroxime 11, (figure (5)), avec du toluène, dans un montage de type Dean-Stark, pour donner l'oxazaborrolidine CBS 8.
31. Faire un schéma d'un montage Dean-Stark et justifier l'intérêt d'utiliser un montage Dean-Stark dans le cas de cette réaction.
31. Faire un schéma d'un montage Dean-Stark et justifier l'intérêt d'utiliser un montage Dean-Stark dans le cas de cette réaction.
Une version protonnée 12 du CBS est utilisée comme catalyseur chiral de la réaction de Diels-Alder entre le cyclohexa-1-3-diène 13 et la méthylacroléine 14 dont la structure est donnée à la figure (6). L'énantiomère majoritaire 15-S a une configuration absolue « S ».
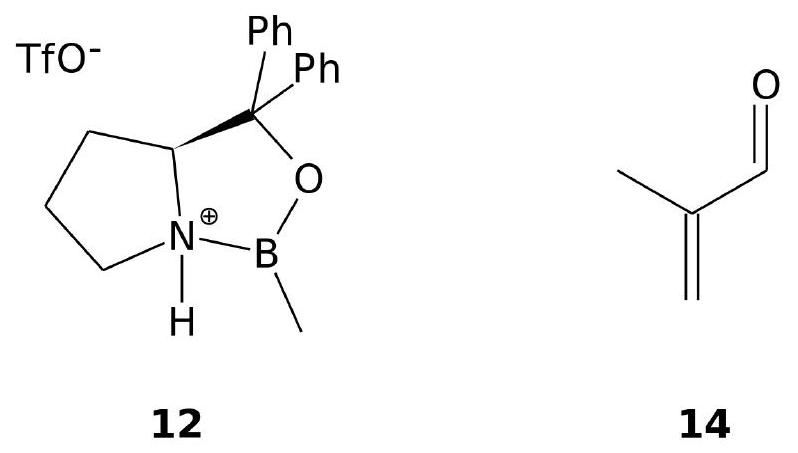
Figure 6 - Structure des produits 12 et 14.
- Donner les produits majoritaires 15 de la réaction de Diels Alder entre ces deux réactifs en l'absence de CBS. Justifier leur stéréochimie à l'aide d'une représentation de l'approche des deux réactifs.
- Proposer une structure pour l'adduit de Lewis
qui se forme entre la methylacroléine et le CBS protonné. - Donner une explication sur le caractère énantiosélectif de la réaction et représenter l'énantiomère majoritaire 15-S (on ne cherchera pas à justifier l'obtention de cet énantiomère plutôt que l'autre).
Figure 7 - Spectre RMN ( 160 MHz )
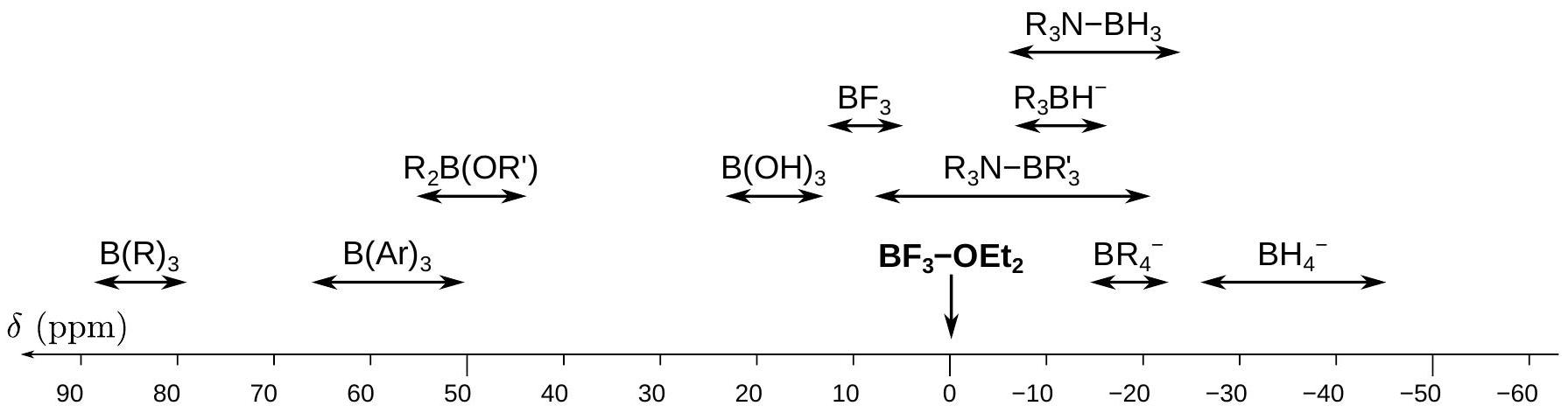
Figure 8 - Table des déplacements chimiques en RMN du bore
Figure 8 - Table des déplacements chimiques en RMN du bore

- Spin nucléaire du
: - Énergie de liaison
2 Annexes.
2.1 Données.
- Nombre d'Avogadro :
- Caractéristiques de
:
Charge partielle
| Bore | Aluminium | Fluor | |
| Numéro atomique | 5 | 13 | 9 |
| Masse molaire atomique
|
10,8 | 27,0 | 19,0 |
| Rayons ioniques
|
|
|
|
| Rayons atomiques
|
|
|
|
- Spin nucléaire du
- Énergie de liaison
\subsection*{2.2 Figures et tables complémentaires.
2 Figures et tables complémentaires.}
- Il s'agit de nombres "moyens", c'est-à-dire non sujets aux fluctuations temporelles d'origine microscopique. Le temps caractéristique de ces dernières est très inférieur à celui de l'évolution de ces nombres et à laquelle nous allons nous intéresser.
- Il s'agit, en réalité, de la section "efficace" de diffusion, ou de collision.
